بیماری ژنتیکی آتروفی عضلانی نخاعی (SMA)
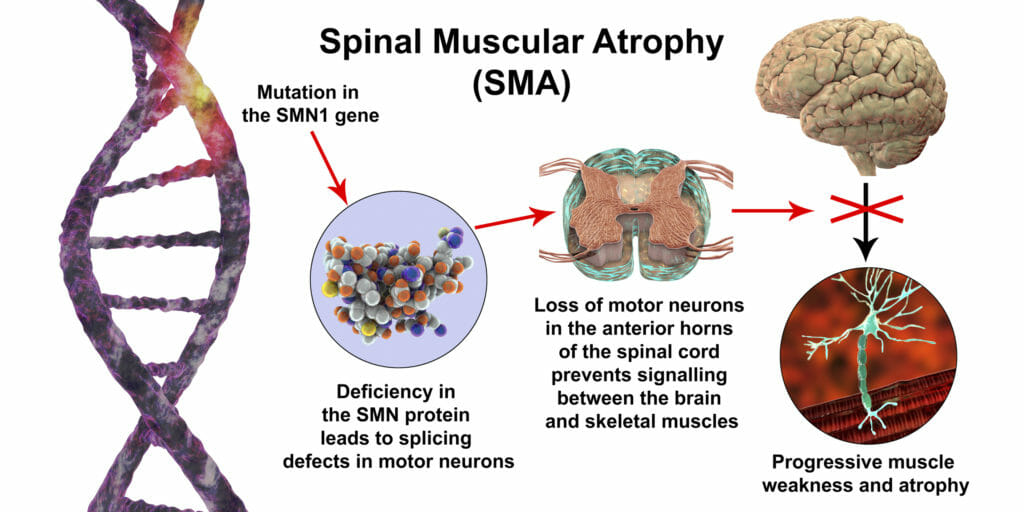
آتروفی عضلانی نخاعی (SMA) یک بیماری ژنتیکی نادر و جدی است که منجر به ضعف و تحلیل عضلات میشود. این بیماری ناشی از موتاسیون در ژن SMN1) Survival Motor Neuron 1) است که پروتئین حیاتی برای عملکرد نورونهای حرکتی را کد میکند. بدون این پروتئین، نورونهای حرکتی دچار تحلیل میشوند و در نهایت از بین میروند، که منجر به ضعف عضلانی و مشکلات حرکتی میشود. با مطالبی درباره بیماری آتروفی عضلانی نخاعی در وبسایت آزمایشگاه ویرا همراه باشید.
انواع آتروفی عضلانی نخاعی (SMA)
SMA به پنج نوع اصلی تقسیم میشود که بر اساس شدت و زمان بروز علائم طبقهبندی میشوند:
- آتروفی عضلانی نخاعی نوع 0: این بیماری پیش از تولد مشهود است و نادرترین و شدیدترین شکل این بیماری SMA است. نوزادان مبتلا در رحم حرکت کمی دارند و در نتیجه اغلب با ناهنجاریهای مفصلی به دنیا میآیند. این نوزادان در زمان تولد دارای تون عضلانی بسیار ضعیف (هیپوتونیا) هستند. عضلات تنفسی آنها بسیار ضعیف است و اغلب به دلیل نارسایی تنفسی در زمان نوزادی فوت می کنند. برخی از نوزادان مبتلا به آتروفی عضلانی نخاعی نوع 0 نیز دارای نقصهای قلبی هستند که از بدو تولد وجود دارد.
- SMA نوع 1 (بیماری وردنیگ-هافمن): این بیماری نیز نوع شدیدی از SMA است که علائم آن در 6 ماه اول زندگی ظاهر میشود. نوزادان مبتلا به نوع 1 قادر به نشستن بدون کمک نیستند و معمولاً نیاز به حمایت تنفسی دارند.
- SMA نوع 2: علائم بین 6 تا 18 ماهگی بروز میکنند. کودکان مبتلا به این نوع ممکن است بتوانند بنشینند اما قادر به راه رفتن نیستند. آنها نیز ممکن است نیاز به حمایت تنفسی پیدا کنند.
- SMA نوع 3 (بیماری کوگلبرگ-ولاندر): علائم بین 18 ماهگی و اوایل دوران بلوغ ظاهر میشوند. افراد مبتلا به این نوع میتوانند راه بروند، اما ممکن است در مراحل بعدی زندگی دچار مشکلات حرکتی شوند.
- SMA نوع 4: این نوع بسیار نادر است و علائم آن در بزرگسالی ظاهر میشود. ضعف عضلانی معمولاً کمتر شدید است و افراد مبتلا به این نوع میتوانند راه بروند.
جهش های ژنی بیماری SMA
جهشهای ژن SMN1 منجر به تمامی انواع آتروفی عضلانی نخاعی یا SMA که در بالا توضیح داده شد میگردد. تعداد نسخههای ژن SMN2 شدت این بیماری را تغییر داده و به تعیین نوع آن کمک میکند.
ژنهای SMN1 و SMN2 هر دو دستورالعملهایی برای ساخت پروتئینی به نام پروتئین SMN را فراهم میکنند. در حالت عادی، بیشترین مقدار پروتئین عملکردی SMN از ژن SMN1 تولید میشود و مقدار کمی نیز از ژن SMN2 تولید میشود. چندین نسخه مختلف از پروتئین SMN از ژن SMN2 تولید میشود، اما تنها یک نسخه عملکردی است؛ نسخههای دیگر کوچکتر بوده و سریعاً تجزیه میشوند. پروتئین SMN یکی از گروه پروتئینهایی است که به عنوان کمپلکس SMN شناخته میشوند و برای حفظ نورونهای حرکتی ضروری هستند. نورونهای حرکتی سیگنالهایی را از مغز و نخاع انتقال میدهند که به عضلات اسکلتی دستور انقباض میدهند، که این امر امکان حرکت بدن را فراهم میکند.
اکثر افراد مبتلا به آتروفی عضلانی نخاعی دارای یک قسمت مفقود از ژن SMN1 هستند که تولید پروتئین SMN را مختل میکند. کمبود پروتئین SMN منجر به مرگ نورونهای حرکتی میشود و در نتیجه سیگنالها بین مغز و عضلات انتقال نمییابند. عضلات بدون دریافت سیگنال از مغز نمیتوانند منقبض شوند، بنابراین بسیاری از عضلات اسکلتی ضعیف شده و تحلیل میروند، که منجر به علائم و نشانههای آتروفی عضلانی نخاعی میشود.
SMN1 و SMN2
به طور معمول، افراد دو نسخه از ژن SMN1 و یک تا دو نسخه از ژن SMN2 در هر سلول دارند. با این حال، تعداد نسخههای ژن SMN2 متفاوت است و برخی افراد ممکن است تا هشت نسخه از این ژن داشته باشند. در افراد مبتلا به آتروفی عضلانی نخاعی، داشتن نسخههای متعدد از ژن SMN2 معمولاً با شدت کمتر این بیماری همراه هست که در سنین بالاتر نیز ظاهر میشوند.
پروتئین SMN تولید شده توسط ژنهای SMN2 میتواند به جبران کمبود پروتئین ناشی از جهشهای ژن SMN1 کمک کند. افراد مبتلا به آتروفی عضلانی نخاعی نوع 0 معمولاً یک نسخه از ژن SMN2 در هر سلول دارند، در حالی که افراد با نوع I معمولاً یک یا دو نسخه، افراد با نوع II معمولاً سه نسخه، افراد با نوع III سه یا چهار نسخه و افراد با نوع IV چهار یا بیشتر نسخه دارند. عوامل دیگر، که بسیاری از آنها ناشناخته هستند، نیز به شدت علائم آتروفی عضلانی نخاعی کمک میکنند.
روشهای تشخیص
تشخیصآتروفی عضلانی نخاعی (SMA) شامل مراحل زیر است:
- ارزیابی بالینی: پزشکان با بررسی علائم بالینی مانند ضعف عضلانی و تحلیل عضلات، و همچنین تاریخچه خانوادگی بیماری، به تشخیص اولیه میپردازند.
- تستهای ژنتیکی: تستهای ژنتیکی برای شناسایی جهش در ژن SMN1 استفاده میشوند. این تستها شامل آنالیز DNA از نمونه خون برای تأیید تشخیص میباشند.
- الکترومیوگرافی (EMG): EMG میتواند فعالیت الکتریکی عضلات را بررسی کرده و ناهنجاریهای ناشی از آسیب به نورونهای حرکتی را شناسایی کند.
روشهای درمان
درمان SMA بسته به نوع و شدت بیماری متفاوت است، و شامل روش های زیر میشود:
- دارودرمانی:
- Nusinersen) Spinraza): این دارو از طریق تزریق به داخل مایع نخاعی (intrathecal) داده میشود. و تولید پروتئین SMN را افزایش میدهد.
- Zolgensma: این درمان ژندرمانی است که یک نسخه عملکردی از ژن SMN1 را به سلولهای بیمار وارد میکند و تنها یک بار تزریق میشود.
- Risdiplam) Evrysdi): این دارو به صورت خوراکی داده میشود و به افزایش تولید پروتئین SMN کمک میکند.
- فیزیوتراپی و کاردرمانی: تمرینات فیزیوتراپی و کاردرمانی میتوانند به تقویت عضلات، بهبود تعادل و هماهنگی، و کاهش خطر افتادن، کمک کنند. این تمرینات شامل تمرینات کششی، تقویتی و تعادلی هستند.
- حمایتهای تنفسی: در مواردی که ضعف عضلات تنفسی وجود دارد، استفاده از دستگاههای کمک تنفسی میتواند به بهبود تنفس و کیفیت زندگی کمک کند.
- مراقبت تغذیهای: بیماران ممکن است به مشکلات تغذیهای دچار شوند و نیاز به رژیمهای غذایی خاص یا تغذیه از طریق لوله داشته باشند.
- مشاوره ژنتیکی: مشاوره ژنتیکی برای خانوادهها میتواند به درک بهتر بیماری و برنامهریزی برای آینده کمک کند. بهترین روش مقابله با این بیماری شناسایی جنین های مبتلا به این بیماری و جلوگیری از فرد مبتلا میباشد. به زوجینی که دارای فرد مبتلا به بیماری SMA در خانواده خود هستند قویاً پیشنهاد می شود که قبل از بارداری از ناقلیت خود با خبر شوند. تا در صورت ناقل بود جهش SMN حتماً از روش های تشخیص بیماری قبل از لانه گزینی یا قبل از تولد بهره مند شوند. این تمهیدات برای جلوگیری از تولد فرد مبتلا به بیماری ژنتیکی انجام می شوند. در نتیجه، بار مالی و عاطفی که به خانواده و جامعه وارد می شود، کاسته میشود.
نتیجهگیری
آتروفی عضلانی نخاعی (SMA) یک بیماری ژنتیکی نادر و جدی است که میتواند تأثیرات قابل توجهی بر کیفیت زندگی بیماران داشته باشد. تشخیص زودهنگام و مدیریت مناسب این بیماری با استفاده از روشهای درمانی جدید و مؤثر، میتواند به بهبود علائم و افزایش طول عمر بیماران کمک کند. با پیشرفتهای علمی در زمینه ژنتیک و درمانهای جدید، امید است که در آینده روشهای درمانی مؤثرتری برای این بیماری پیدا شود و کیفیت زندگی بیماران بهبود یابد. برای کسب آگاهی بیشتر با شماره های آزمایشگاه ژنتیک ویرا تماس حاصل نمایید.