مقدمه
نقص ایمنی ترکیبی شدید یا SCID، به عنوان آگاماگلوبولینمی نوع سوئیسی نیز شناخته میشود، شایع ترین اختلال ارثی ایمنی اکتسابی با واسطه سلول است. نوزادان مبتلا به SCID در بدو تولد سالم به نظر می رسند اما بسیار مستعد ابتلا به عفونت های شدید هستند. به همین دلیل در محفظه ای استریل و بدون تماس با محیط اطراف نگهداری می شوند.

بیماری نقص ایمنی ترکیبی شدید یا SCID
این بیماری با افزایش استعداد ابتلا به عفونت های ویروسی و باکتریایی به دلیل اختلال شدید در ایمنی همورال و سلولی همراه است. در بیماری SCID نقص در تکوین سلول های T وجود دارد. این نقص منجر به فقدان ایمنی سلولی با واسطه سلول های T در این بیماران می شود. علائم بالینی در کودکان مبتلا با عفونت های فرصت طلب مکرر و مستمر ناشی از میکروارگانیسم هایی مانند کاندیدا آلبیکینس، سایتومگالوویروس و … همراه است. نرخ بروز بیماری SCID تقریباً ۱ به ۷۵۰۰۰ تولد است. معمولاً مرگ مبتلایان در نوزادی در صورت عدم پیوند مغز استخوان، ژن درمانی یا آنزیم درمانی رخ می دهد.
توارث بیماری نقص ایمنی ترکیبی شدید یا SCID
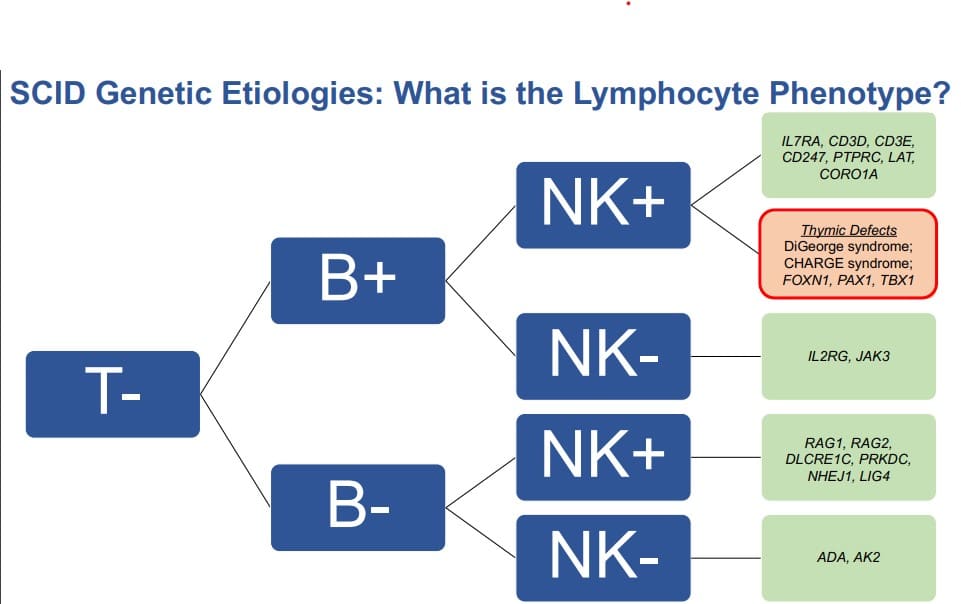
SCID از لحاظ ژنتیکی بیماری هتروژنی است و می تواند با الگوی وابسته به X (که شایع ترین فرم SCID در مردان مبتلا است) و یا اتوزومی مغلوب به ارث برسد.
در فرمی از بیماری که توارث وابسته به X دارد جهش در ژن (IL-2RG) رخ می دهد و ۶۰٪ موارد بیماری SCID را به خود اختصاص داده است. پسران مبتلا به این نوع SCID دارای گلبول های سفیدی هستند که به طور غیر طبیعی رشد و توسعه می یابند. در نتیجه، تعداد کمی از سلول های T و سلول های کشنده طبیعی دارند و سلول های B آن ها فاقد عملکرد است.
در مواردی از بیماری که ناشی از توارث اتوزومال مغلوب است:
اگر فرد دارای سلول های B ایمنی باشد (+T-B) نقص در یکی ژن های CD45، JAK3 و یا IL7R است.
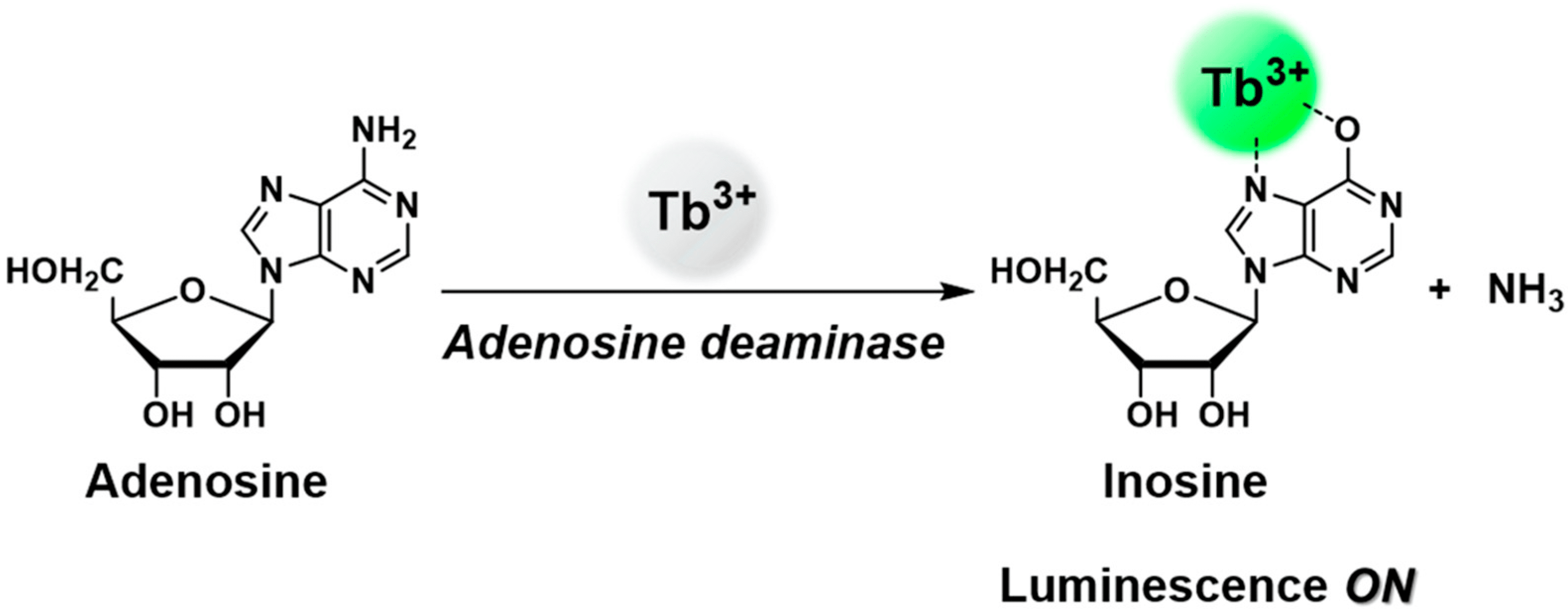
اگر فرد فاقد سلول های B ایمنی هم باشد (-T-B) نقص در آنزیم آدنوزین دآمیناز (ADA) می تواند عامل بیماری باشد. یک سوم موارد SCID با توارث اتوزومی مغلوب به دلیل نقص این آنزیم روی می دهد. اشکال نادر بیماری SCID که افراد فاقد سلول های B هستند به دلیل جهش در ژن های RAG1/RAG2 و ARTEMIS و AK2 هم رخ می دهد.
روش های درمان بیماری نقص ایمنی ترکیبی شدید یا SCID
رایج ترین درمان برای SCID پیوند مغز استخوان است. پیوندهایی که در سه ماه اول زندگی انجام می شود، از میزان موفقیت بالایی برخوردار هستند. پزشکان همچنین در پیوندهای داخل رحمی که قبل از تولد کودک انجام شده و همچنین با استفاده از خون بند ناف که سرشار از سلول های بنیادی است، موفقیت هایی داشته اند. پیوندهای داخل رحمی جنین مزیت ایجاد یک سیستم ایمنی عملکردی را در محیط استریل رحم دارد؛ با این حال عوارضی مانند GVHD در صورتی که رخ دهد، تشخیص یا درمان را دشوار خواهد ساخت.
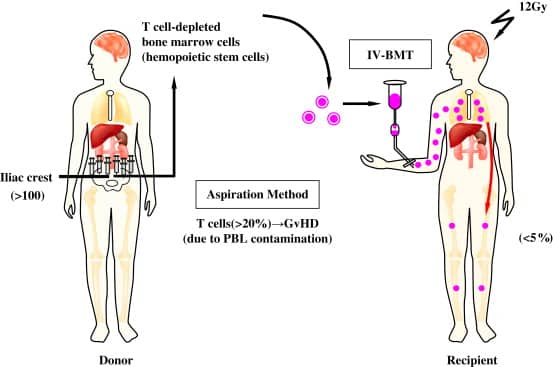
اخیراً ژن درمانی به عنوان جایگزینی برای پیوند مغز استخوان مطرح شده است. انتقال ژن از دست رفته به سلول های بنیادی خونساز با استفاده از ناقل های ویروسی در ADA SCID و SCID مرتبط با X در حال آزمایش است.
یکی از درمان هایی برای بیماران مبتلا به ADA-SCID، درمان جایگزینی آنزیم است که در آن به بیمار آدنوزین دآمیناز همراه با پلی اتیلن گلیکول (PEG-ADA) تزریق می شود. درمان با PEG-ADA ممکن است برای بازگرداندن عملکرد سلولهای T در کوتاه مدت مورد استفاده قرار گیرد، به طوری که قبل از ادامه با درمان های اساسی تر مثل پیوند مغز استخوان، عفونتهای موجود را پاک کند.
همچنین جداسازی بیمار از هر گونه پاتوژن مضر موجود در محیط خارجی از جمله روش های دیگر برای جلوگیری از عفونت های مکرر در بیماران مبتلا به SCID است. فرد بیمار در این شرایط در شرایط استریل و ایزوله زندگی می کند.
نتیجه گیری
تشخیص این بیماری در آزمایشگاه ژنتیک پزشکی ویرا با تست WES یا توالی یابی اگزوم قابل انجام است. این تکنیک در آزمایشگاه ژنتیک پزشکی ویرا با بهره مندی از جدیدترین متد روز دنیا و آنالیز توسط هوش مصنوعی انجام می گیرد. مدت زمان جواب دهی ۳۰ روز کاری می باشد.

